유한양행의 비소세포폐암 치료제인 렉라자(LECLAZA®)가 미국 식품의약국(FDA)으로부터 시판 허가를 받았습니다.
렉라자란?
렉라자는 비소세포폐암 치료제로, 성분명은 레이저티닙입니다.
이 약물은 상피세포 성장인자 수용체(EGFR) 엑손 19 결손 또는 엑손 21(L858R) 치환 변이가 확인된 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 성인 환자의 1차 치료제로 사용됩니다.
FDA 승인 배경

렉라자는 지난 2월 FDA의 우선심사대상으로 지정되어 심사를 받아왔습니다.
그리고 드디어 8월 20일, FDA로부터 시판 허가를 받게 되었습니다.
이로써 렉라자는 미국 시장에 진출하는 첫 국산 항암제가 되었습니다.
렉라자의 의미
이번 FDA 승인은 유한양행뿐만 아니라 한국 제약 산업 전체에 큰 의미를 갖습니다.
렉라자는 글로벌 제약사인 존슨앤드존슨(J&J)의 항암제 리브리반트(성분명: 아미반타맙)와 병용 요법으로 승인받았으며, 이는 국산 항암제가 글로벌 시장에서 인정받는 중요한 사례가 될 것입니다.
앞으로의 전망
유한양행은 이번 FDA 승인을 통해 글로벌 톱 50 제약사로 도약하는 목표에 한 걸음 더 다가섰습니다.
앞으로도 렉라자가 많은 환자들에게 희망을 줄 수 있기를 기대합니다.
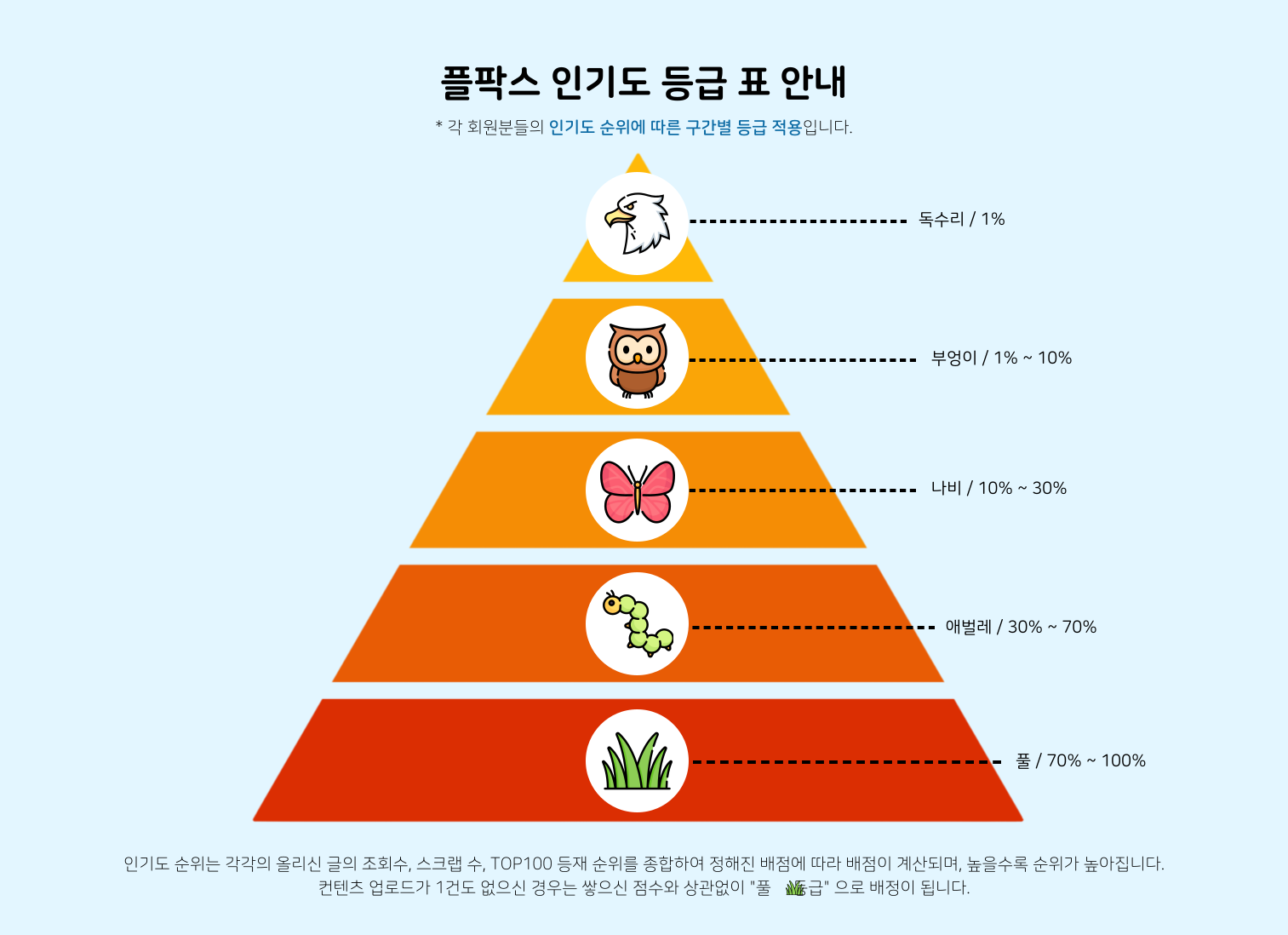
 컨텐츠
컨텐츠